A. Senyawa poliena
Poliena merupakan senyawa yang mengandung lebih dari dua ikatan rangkap.Salah satu cohtoh senyawa poliena yatu Karotenoid.
Karotenoid merupakan senyawa poliena isoprenoid yang bersifat lipofilik atau tidak larut dalam air,mudah di isomerisasi dan di oksidasi, menyerap cahaya,meredam oksigen, memblok reaksi radikal bebas dan dapat berikatan dengan permukaan hidrofobik. Karotenoid ini dibentuk oleh penggabungan 8 unit isoprene(C5) dan pada umumnya unit-unit isoprene ini berikatan secara kepala-ekor, kecuali pada pusat molekul berikatan secara ekor-ekor yang menjadikan molekul karotenoid simetris (Gross,1991). Ikatan kepala ekor dan ekor ekor pada isoprene dapat dilihat pada gambar dibawah ini :
karatenoid dapat dikelompokkan menjadi dua golongan besar yaitu karotenoid hidrokarbon tidak jenuh yang dikenal sebagai karoten dan turunan karoten teroksigenasi yang disebut xantofil hidroksi(kriptoksantin),keto(kantaksantin),epoksi(violaksantin),dan aldehid(citraurin).Terdapat dalam bentuk asiklik(likopen), monosiklik(karoten), atau disiklik(karoten).
Sistem ikatan rangkap terkonjugasi yang mengandung ikatan tunggal dan rangkap dengan elektron yang secara efektif terdelokalisasi disepanjang rantai poliena, merupakan ciri dari karotenoid. Ciri ini merupakan tanggung jawab terhadap bentuk molekul reaktivitas kimia dan sifat penyerapan cahaya, Oleh karena itu karotenoid memiliki warna.(britton,1995). Ikatan rangkap terkonjugasi berjumlah 7 dibutuhkan untuk memberi warna karotenoid masing-masing ikatan rangkap pada rantai polimer dari sebuah karotenoid dapat ditemukan dalam dua konfigurasi yaitu isomer geometri Trans atau cis karotenoid yang terdapat di alam sebagian besar dalam bentuk all trans dalam kehidupan poliena ini dapat menyebabkan timbulnya warna pada wortel dan tomat.
Karotenoid merupakan senyawa poliena isoprenoid yang bersifat lipofilik atau tidak larut dalam air,mudah di isomerisasi dan di oksidasi, menyerap cahaya,meredam oksigen, memblok reaksi radikal bebas dan dapat berikatan dengan permukaan hidrofobik. Karotenoid ini dibentuk oleh penggabungan 8 unit isoprene(C5) dan pada umumnya unit-unit isoprene ini berikatan secara kepala-ekor, kecuali pada pusat molekul berikatan secara ekor-ekor yang menjadikan molekul karotenoid simetris (Gross,1991). Ikatan kepala ekor dan ekor ekor pada isoprene dapat dilihat pada gambar dibawah ini :
karatenoid dapat dikelompokkan menjadi dua golongan besar yaitu karotenoid hidrokarbon tidak jenuh yang dikenal sebagai karoten dan turunan karoten teroksigenasi yang disebut xantofil hidroksi(kriptoksantin),keto(kantaksantin),epoksi(violaksantin),dan aldehid(citraurin).Terdapat dalam bentuk asiklik(likopen), monosiklik(karoten), atau disiklik(karoten).
Sistem ikatan rangkap terkonjugasi yang mengandung ikatan tunggal dan rangkap dengan elektron yang secara efektif terdelokalisasi disepanjang rantai poliena, merupakan ciri dari karotenoid. Ciri ini merupakan tanggung jawab terhadap bentuk molekul reaktivitas kimia dan sifat penyerapan cahaya, Oleh karena itu karotenoid memiliki warna.(britton,1995). Ikatan rangkap terkonjugasi berjumlah 7 dibutuhkan untuk memberi warna karotenoid masing-masing ikatan rangkap pada rantai polimer dari sebuah karotenoid dapat ditemukan dalam dua konfigurasi yaitu isomer geometri Trans atau cis karotenoid yang terdapat di alam sebagian besar dalam bentuk all trans dalam kehidupan poliena ini dapat menyebabkan timbulnya warna pada wortel dan tomat.
B. Zat warna
Menurut Otto N.Witt (1876) bahwa zat warna dalam senyawa organik dikaitkan dengan adanya gugus tertentu dalam molekul. Ia menyebut gugus tersebut yang memberikan warna sebagai kromosfor. Berikut merupakan kromosfer kromosfer yang paling aktif :
Adanya salah satu gugus kromofor dalam suatu molekul sudah cukup untuk memberikan warna. Seperti nitrobenzena berwarna hijau muda, Azo benzena berwarna oranye merah, p-quinones berwarna kuning, O-quinones berwarna oranye atau merah. Terdapat gugus gugus tak jenuh tertentu lainnya yang dapat memberikan warna jika mengalami konjugasi yaitu etilena, karbonil,ezometina.
Witt juga menyebutkan bahwa terdapat gugus tertentu yang dapat mengintensifkan warna tetapi tidak memberikan warna yang disebut auksokrom. Gugus auksokrom yang paling aktif yaitu -OH,-NHR,-NH2,dan -NR2.
permasalahan
1. jelasksn peranan senyawa Azo dalam bidang industri beserta karakter warna yang ditimbulkan?
2. jelaskan proses terbentuknya warna pada wortel yang disebabkan oleh poliena?
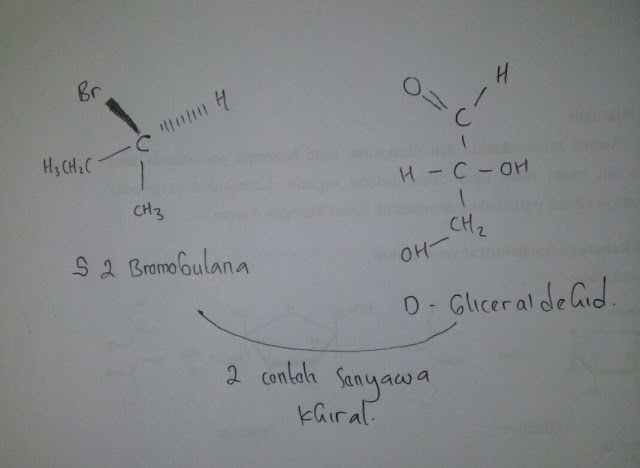
3. Salah satu manfaat dari karatenoid yaitu menurunkan resiko beberapa penyakit kronis,Jelas kan bagaimana proses tersebut bisa terjadi?
permasalahan
1. jelasksn peranan senyawa Azo dalam bidang industri beserta karakter warna yang ditimbulkan?
2. jelaskan proses terbentuknya warna pada wortel yang disebabkan oleh poliena?
3. Salah satu manfaat dari karatenoid yaitu menurunkan resiko beberapa penyakit kronis,Jelas kan bagaimana proses tersebut bisa terjadi?